Новые методы диагностики рака: физик рассказала о разработках Центра онкологии им. Н.Н. Петрова
Дата публикации: 05.04.2021
Мария Слюсаренко – научный сотрудник НМИЦ онкологии им. Н.Н. Петрова и аспирантка физического факультета СПбГУ – работает в научной лаборатории субклеточных технологий с группой онкоэндокринологии всего два года. Но за это время молодой ученый успела реализовать уже два перспективных проекта, результаты которых используются для разработки уникальных методов диагностики онкологических заболеваний.
– Мария, чем занимается лаборатория субклеточных технологий с группой эндокринологии НМИЦ онкологии им. Н.Н. Петрова?
– Организм человека может исследоваться и рассматриваться при «разном увеличении»: на уровне тканей, клеток, молекул, атомов ит.д. Между клетками и молекулами существует еще один, плохо изученный «уровень организации» – субклеточный. Это различные комплексы молекул, биология которых имеет свои особенности. Мы занимаемся изучением этих субстанций, преимущественно тех, что имеют структуру везикул, а также разрабатываем на их основе новые методы ранней диагностики онкологических заболеваний и оценки эффективности противоопухолевого лечения.

– Большинство проектов лаборатории связаны с нановезикулами. Что это такое и почему эти биоструктуры стали основой для разработки новых методов диагностики рака?
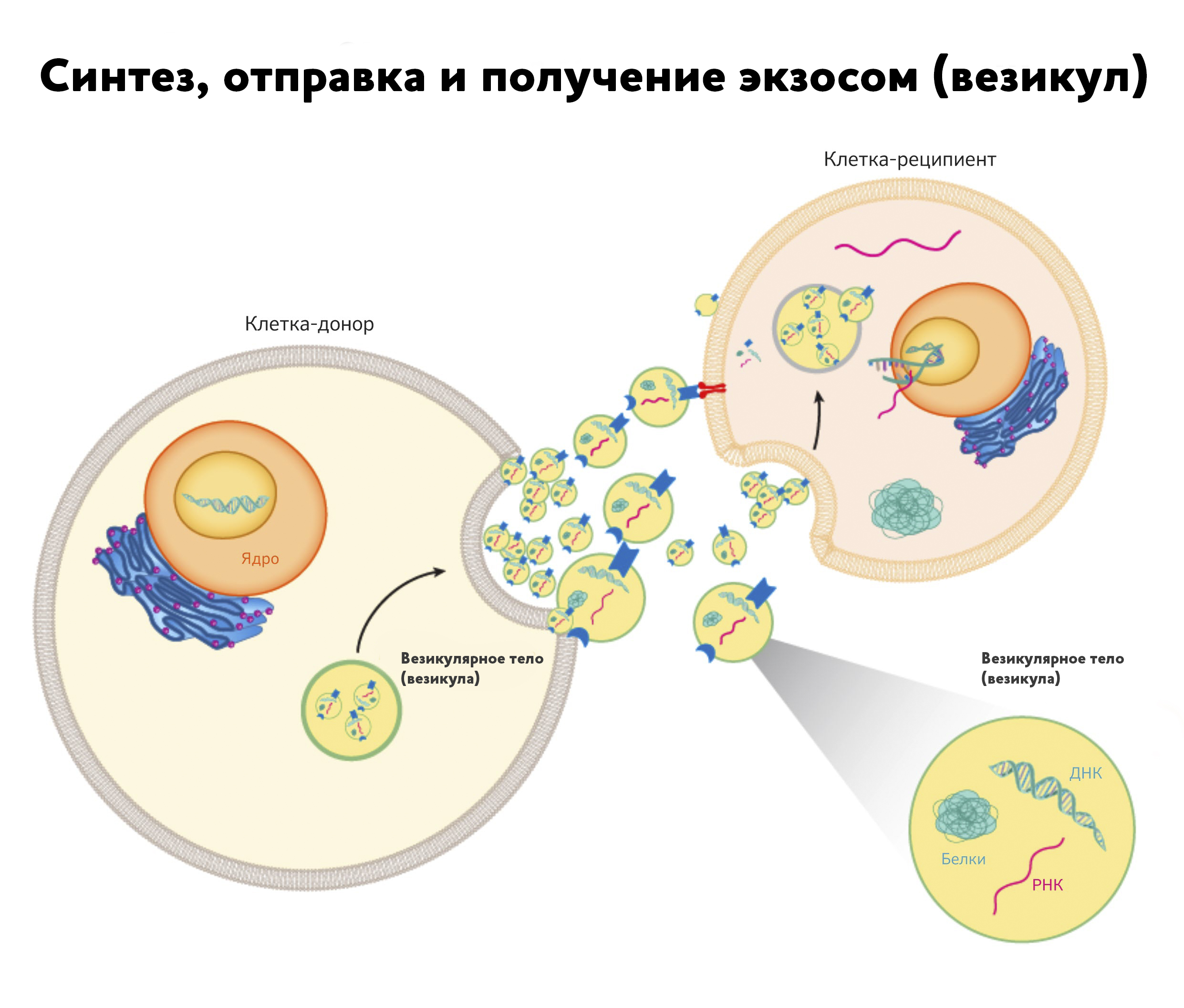
– Учеными доказано, что клетки организма общаются друг с другом, они передают информацию. Инструментом для передачи информации как раз служат нановезикулы–пузырьки диаметром 80-150 нанометров, образованные билипидной мембраной. Везикулы продуцируются, то есть производятся, всеми клетками организма. Они содержат в себе липиды, протеины и РНК родительских клеток, по сути, они являются «отпечатками» родительской клетки и могут многое рассказать о ней. По их составу иногда можно понять, какая клетка их секретировала, и в каком она была состоянии.
Везикулы попадают в межклеточное пространство, а затем и в остальные биологические жидкости, такие как кровь, слюна, спинно-мозговая жидкость и т.д. Везикулы могут взаимодействовать с клетками анатомически отдаленных тканей, перенося сигнальные или структурные молекулы, и таким образом влиять на биологию клеток-реципиентов.
Наша лаборатория занимается изучением нановезикул, которые производятся всеми клетками организма, в том числе и опухолевыми клетками, и циркулируют в крови человека. Везикулы являются «биохимическими портретами» родительских клеток, то есть, изучив везикулы, которые были секретированы опухолевыми клетками, мы можем получить важную информацию о свойствах опухоли.
– Как построена работа в научной лаборатории?
– В нашей лаборатории трудятся различные специалисты – биологи, химики, физики, врачи. У каждого научного сотрудника есть как минимум один научный проект. Идея проекта либо рождается внутри лаборатории, либо приходит извне – к нам могут обратиться клинические специалисты.
В работе любого научного сотрудника есть две составляющие – аналитическая и экспериментальная. Работа над проектом начинается именно с аналитической части. Коллектив анализирует мировую научную литературу по теме исследования, строит гипотезу, составляет дизайн, то есть план исследования. Затем мы подбираем необходимые реагенты и оборудование.
Далее мы проводим экспериментальную работу. Часто, если не всегда, эксперимент не получается с первого раза – и это нормально. Иногда нужны сотни попыток.
Когда экспериментальная система готова, то есть постановка эксперимента отлажена, мы начинаем работать с клиническими образцами, в большинстве исследований это образцы крови, реже – ткани или культуры опухолевых клеток.
Исследование циркулирующих везикул начинается с выделения жидкой части крови – плазмы, затем из плазмы выделяются все нановезикулы. Но эта популяция очень гетерогенна, в ее состав входят везикулы, продуцируемы разными клетками организма. Поэтому мы разрабатываем методы выделения отдельных фракций везикул, несущих диагностически значимую информацию. Важным аспектом является оценка качества выделенных везикул – размер, концентрация и химический состав. Это важно, так как размер везикул не позволяет их оценить невооруженным глазом или с помощью светового микроскопа. Если все параметры в норме – мы ставим эксперимент, а результаты отслеживаем с помощью специального оборудования –проточного цитометра, анализатора траекторий наночастиц, спектрофотометра.
После ряда экспериментов мы вновь возвращаемся к аналитике –необходимо осмыслить полученные данные, выявить те или иные закономерности, сравнить их с результатами коллег, работающих над сходными задачами. Определенным этапом работы является научная статья, а результатом – разработка нового метода диагностики или терапии, который имеет потенциал внедрения в клиническую практику.

– Как лично вы пришли к решению стать ученым–физиком?
– В детстве я мечтала стать математиком– также как и мой отец. Думала, что понимание формул и теорем откроет мне все секреты мироздания. Но в восьмом классе поступила в Академическую гимназию СПбГУ и увлеклась экспериментальной физикой, а также научно-популярной литературой в области биофизики, биомедицинской физики и молекулярной биологии. Вообще, каждый биологический процесс имеет под собой химическую подоплеку, а каждый химический – физическую. Все имеет какое-то физическое обоснование, поскольку мы живем в физическом мире. Я решила заниматься наукой, чтобы сделать свой вклад в развитие человечества. Уже в подростковом возрасте поняла, что решение медицинских задач с помощью физических подходов – тот путь, где могу себя реализовать. Так я поступила в СПбГУ на физический факультет.
– Вы работаете в НМИЦ онкологии им. Н.Н. Петрова уже два года. Почему решили трудиться именно здесь?
– В магистратуре я познакомилась с девушкой, которая работала в этой лаборатории. Она рассказала о научных исследованиях, о своих обязанностях, и я заинтересовалась. Я пришла на собеседование к заведующей лабораторией – Анастасии Валерьевне Малек. Начали со знакомства с научной литературой по тематике работы лаборатории. Я прочитала работы сотрудников лаборатории, нашла дополнительную литературу по предметам исследований. В итоге на основе прочитанного, я захотела реализовать один проект. Анастасия Валерьевна меня поддержала, и я начала работать.
– Ваш первый проект был посвящен выделению везикул, и он существенно помог оптимизировать работу лаборатории субклеточных технологий. Расскажите о нем подробнее.
– Если говорить просто – я оптимизировала способ выделения везикул из плазмы крови, применяя физические и физико-химические явления.
Как я уже говорила, везикулы могут стать основой для новых методов диагностики. Но одна из основных проблем на пути разработки таких методов – отсутствие удобного для рутинной практики метода выделения везикул из крови. По стандартной технологии ультра-центрифугирования процесс выделения везикул из дюжины образцов мог занимать целый рабочий день. Это определяло актуальность задачи.
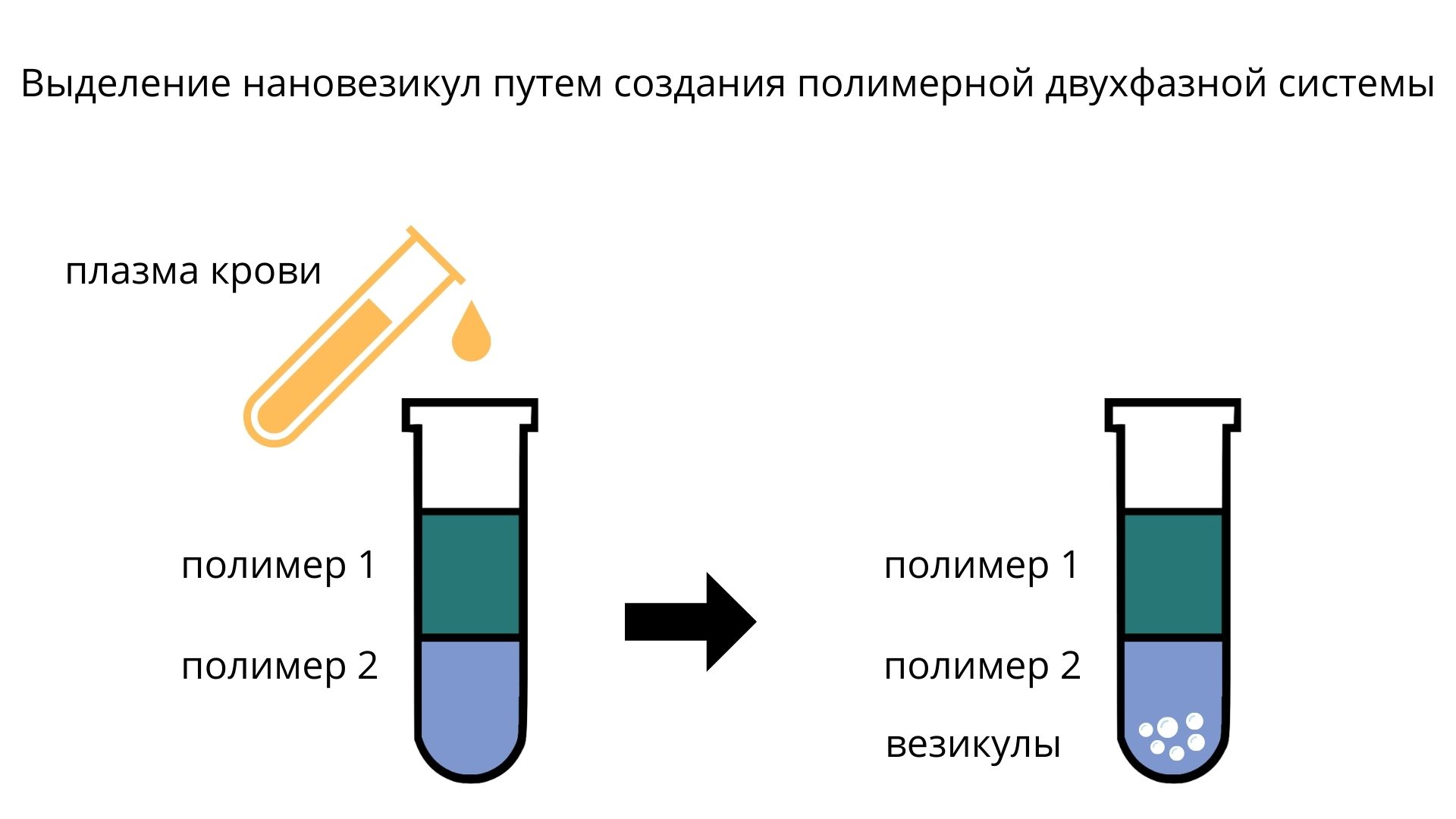
Я обучалась в СПбГУ по направлению «физика функциональных наноматериалов». Полученные знания и изучение научной литературы привели к мысли о том, что везикулы можно выделять с помощью полимеров, точнее, путем создания так называемой полимерной двухфазной системы. Если смешать два полимера в жидкости, то при определенных соотношениях их концентраций произойдет расслоение раствора на две фазы: верхнюю и нижнюю. Этот феномен был давно известен, но для решения задачи выделения нановезикул он был использован лишь дважды: группами корейских и турецких исследователей. Мы проанализировали эти работы, определили пути оптимизации технологии. Затем было несколько месяцев планомерных исследований – подбирали оптимальное соотношение молекулярных масс и концентраций двух полимеров, анализировали характеристики выделенных везикул.
В пробирке с плазмой крови мы растворяли два полимера, раствор разделялся на две фазы. В нижней фазе концентрировались нановезикулы, а в верхней - остальные компоненты плазмы. В итоге такой метод выделения оказался достаточно быстрым и эффективным, для анализа можно использовать даже 1,5 мл плазмы. А за день в лаборатории можно выделить везикулы из 100 образцов. Результаты этой работы опубликованы в журнале PolymersMDPI, а технология стала частью разрабатываемых методов диагностики.

– Второй проект, над которым вы работаете, призван улучшить оценку эффективности лечения пациентов с диагнозом лимфома Ходжкина. Какая клиническая проблема стояла перед вами и как вы ее решили?
– Лимфома Ходжкина – это онкологическое заболевание лимфатической системы. Оно довольно успешно лечится современными противоопухолевыми препаратами, но существует проблема адекватной и своевременной оценки эффекта терапии. На данный момент оценка производится с помощью ПЭТ-КТ с введением контрастного вещества. Но этот метод диагностики сопряжен с лучевой нагрузкой, доступен лишь в нескольких учреждениях нашего города,и немаловажным фактором, ограничивающим его применение, является высокая стоимость. Но даже в случае проведения процедуры ПЭТ-КТ, оценка результатов не всегда дает четкий ответ на основной клинический вопрос: достаточен или избыточен выбранный режим терапии? В силу объективных ошибок часть пациентов получают недостаточное лечение, что приводит к рецидивам, а часть, наоборот, получают избыточное лечение, что сопряжено с риском побочных эффектов.
Эта проблема была обозначена докторами отделения онкогематологии нашего Центра, и мы предложили технологию ее решения. Работа над проектом потребовала координации усилий сотрудников нашей лаборатории, врачей клинического отделения и отделения радионуклидной диагностики, так как мы должны были разработать технологию, оценить ее эффективность на клинических образцах и сравнить результаты нашего анализа и традиционного метода ПЭТ-КТ.
В основе нашей разработки лежат два интересных явления. Во-первых, феномен фермент-миметической активности наноматериалов, в нашем случае – золота. Если металл перевести в наноформу, то он начинает работать как химический катализатор, окисление некоторых субстратов проявляется цветной реакцией и может быть измерена методами колориметрии. Во-вторых, известно, что нуклеиновые кислоты (прим. – ДНК), являясь анионными (прим. – негативно заряженными) полимерами, могут адсорбироваться на поверхности наночастиц и «выключать» их ферментативную активность. В тоже время и по тем же причинам молекулы ДНК могут иметь определенную специфическую и стабильную пространственную организацию, которая фиксируется внутримолекулярными связями между участками цепи полимера. В природе такие структуры обеспечивают взаимодействия молекул РНК и белков. Современные биотехнологические подходы позволяют создавать такие ДНК- или РНК- «ключи», подходящие к разным молекулам, или лигандам. Такие ДНК-«ключи» называются ДНК-аптамерами. Получается, что ДНК-аптамер может и «включать/выключать» наночастицы золота и специфично связывать определенный лиганд. Зачем это нужно?
Чтобы ответить на этот вопрос, необходимо обратиться к изучаемому заболеванию. Клетки лимфомы Ходжкина продуцируют ряд белков, например, специфической особенностью этих клеток является экспрессия мембранного маркера CD30. Везикулы, которые вырабатываются клетками лимфомы Ходжкина, также должны иметь в составе мембраны маркер CD30. Мы предположили, что чем больше в организме клеток Ходжкина, тем, по идее, должно быть больше в плазме везикул, имеющих этот маркер. То есть количество таких CD30(+) везикул может отражать активность заболевания и быть критерием оценки эффекта терапии. Но доступные технологии анализа недостаточно чувствительны для проведения такой оценки.
Для решения этой задачи мы и решили использовать свойства наночастиц золота и аптамеров. Наночастицы золота для этого эксперимента синтезировали наши коллеги из Сколковского института науки и технологий. Структуру аптамера, специфично связывающего маркер CD30, мы подсмотрели в публикациях.
Итак, мы смоделировали динамическую систему из наночастиц золота, везикул и аптамеров. Причем, аптамер в этой системе может взаимодействовать и с золотом, и с везикулами. Чем больше в системе везикул, тем больше молекул аптамера они связывают, и тем больше частиц золота освобождается и «включается». Добавляя субстрат и оценивая интенсивность цветной реакции, мы можем оценивать состояние системы и относительное количество везикул. Если в системе используется аптамер, связывающий маркер CD30, система теоретически является технологией анализа количества CD30(+) везикул и клинической активности заболевания.
В ходе работы над этим проектом нужно было решить много технологических задач. Какие частицы оптимальны? Можем ли добиться «выключенного» и «включенного» состояния этих наночастиц? Если можем, то каким образом? Какой субстрат использовать? На каких длинах волн оценивать интенсивность цветной реакции? Какой конкретно белок может работать маркером везикул, секретируемых клетками Ходжкина? В каких условиях и при каких концентрациях компонентов система будет работать оптимально? Каковы условия проведения всех реакций и так далее. Это долгая работа привела к успешному результату. Мы разработали аналитическую систему, провели предварительную оценку эффективности анализа уже на 16 пациентах. Дело за малым: сделать прототип диагностического набора, зарегистрировать его как изделие медицинского назначения, провести масштабное клиническое исследование. Если все это удастся – разработанный метод будет прост в исполнении, безопаснее для пациентов, дешевле, а возможно, информативнее, чем ПЭТ-КТ.
Беседовала Иоанна Чернова
