Обзор ключевых новостей ASCO 2021 по лекарственной терапии ЗНО
Дата публикации: 09.06.2021
С 4 по 8 июня состоялся очередной конгресс Американского общества клинической онкологии (American Society of Clinical Oncology, ASCO) в онлайн формате. Ежегодно конференция ASCO объединяет более 45 000 специалистов в области онкологии. Сотрудники НМИЦ онкологии им. Н.Н. Петрова в последние годы представили на ASCO 113 научных тезисов, 13 из них – в 2021 году.
В обзоре приведены основные ключевые результаты исследований, представленные на заседаниях конгресса, которые касались вопросов противоопухолевой лекарственной терапии. Обзор подготовили д.м.н. Татьяна Юрьевна Семиглазова, заведующая научным отделом инновационных методов терапевтической онкологии и реабилитации НМИЦ им. Н.Н. Петрова и клинический ординатор Софико Мамуковна Шарашенидзе.
Обсуждение будет продолжено на форуме «Белые ночи» 2021!
Рак молочной железы (РМЖ)
Наиболее обсуждаемыми в ходе конгресса ASCO 2021 были промежуточные результаты III фазы Olympia: исследования эффективности применения в адъювантном режиме PARP-ингибитора олапариба против плацебо у больных ранним gBRCAmHER2- РМЖ группы высокого риска [1].
Примечание
Под факторами высокого риска рецидива подразумевались:
· трижды негативный РМЖ при ≥pT2 или ≥pN1 до проведения адъювантной химиотерапии (АХТ) или при отсутствии достижения полного патоморфологического регресса (pCR) после неоадъювантной химиотерапии (НАХТ);
· ER+ РМЖ с≥4 пораженными лимфоузлами до проведения АХТ или при отсутствии достижения pCR и индексе ≥3 CPS‐EG (клинико-патологическая стадия + [HR+] + степень злокачественности [G] ) после НАХТ.
При медиане наблюдения 2,5 года в исследовании были проанализированы сведения о 1836 больных ранним gBRCAmHER2- РМЖ группы высокого риска, которые 1:1 в адъювантном режиме в течение года принимали олапариб или плацебо. Больные ER+рРМЖ получали олапариб или плацебо на фоне гормонотерапии (АГТ)+/- золедроновая кислота (после 1 года исследования больные продолжали прием АГТ). Так как на момент начала исследования эффективность капецитабина у больных ТНРМЖ при наличии резидуальной опухоли после НАХТ еще не была доказана, то больным трижды негативным биологическим под типом капецитабин в адъювантном режиме не назначался.
Результаты
· 3-летняя выживаемость без признаков инвазивного заболевания (рис. 1) составила 85,9% в группе олапариба и 77,1% в группе плацебо (95% ДИ [4,5–13,0]; ОР инвазивного заболевания или смерти был равен 0,58 (95% ДИ [0,41–0,82]; p<0,001).
· 3-летняя выживаемость без отдаленных метастазов — 87,5% в группе олапариба и 80,4% в группе плацебо (95% ДИ [3,0–11,1]; ОР отдаленного метастазирования и смерти — 0,57 (95% ДИ [0,39–0,83]; p<0,001).
· В группе больных, получавших олапариб, наблюдалось меньшее число смертей (59 и 86 соответственно) (ОР = 0,68; 95% ДИ [0,44–1,05]; р=0,02); однако разница не была достоверной, учитывая заявленную исследователями значимую границу при p<0,01.
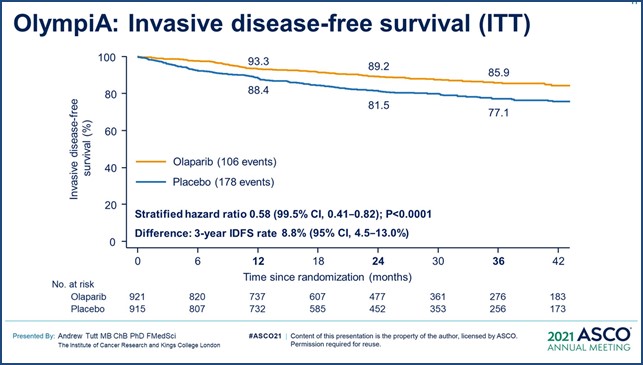
Рисунок 1 – Исследование III фазы Olympia: адъювантная терапия олапарибому больных ранним gBRCAmHER2- РМЖ группы высокого риска [1].
Токсический профиль
· Побочными явлениями 3-степени, которые возникли более чем у 10% пациентов, получавших олапариб, были анемия (8,7%), нейтропения (4,8%), лейкопения (3,0%) и усталость (1,8%).
· У пациентов в группах олапариба и плацебо не возрастала частота серьезных побочных эффектов и нежелательных явлений, представляющих особый интерес, включая миелодиспластический синдром/острый миелоидный лейкоз, злокачественного новообразования (8,7% против 8,4%) и пневмонита (2,6% против 4,6%) соответственно.
NB! У больных ранним gBRCAmHER2- РМЖ группы высокого риска, получавших олапариб в адъювантном режиме в течении года, снижался риск смерти от рецидива заболевания на 42%; по причине отдаленного метастазирования — на 43%. Назрела необходимость генетическое тестирования мутаций в генах BRCA1/2теперь уже и у пациентов с ранним HER2- РМЖ высокого риска развития рецидива заболевания.
Рак почки
Choueiri T. K. и соавторы [2] представили не менее ожидаемые результаты KEYNOTE–564: исследования эффективности пембролизумаба против плацебо в адъювантном режиме после нефрэктомии у больных светлоклеточным раком почки.
Примечание
Основными критериями включения были:
· промежуточного риска (pT2, Gr4 или саркоматоидный подтип, N0 M0 или pT3, любой Gr, N0 M0);
· высокого риска (pT4, любой Gr, N0 M0 или pT любая стадия, любой Gr, N+ M0);
· M1 NED (без признаков заболевания после полной резекции первичной опухоли и метастазов в мягких тканях ≤1 года после нефрэктомии).
Были проанализированы сведения о 994 пациентах, которые были рандомизированы в группу пембролизумаба или плацебо.
Результаты
· При первом промежуточном анализе (рис.1) была достигнута первичная конечная точка – выживаемость без признаков заболевания (ОР=0,68 (95%ДИ [0,53−0,87]; р=0,0010).
· Предполагаемая 2-годичная выживаемость без признаков заболевания составила 77,3% в группе пембролизумаба против 68,1% группы плацебо.
· Предполагаемая 2-годичная общая выживаемость(ОВ)- 96,6% против 93,5% соответственно.
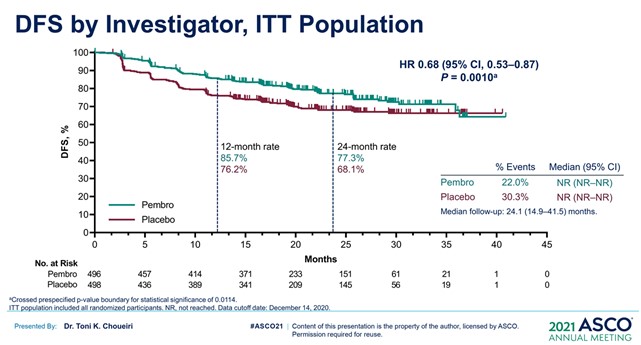
Рисунок 2 – Исследование III фазы KEYNOTE–564: адъювантная терапия пембролизумабом против плацебо после нефрэктомии у больных раком почки [2].
NB! KEYNOTE-564 — первое успешное исследованием III фазы иммунотерапии в адъювантном режиме при раке почки. Пембролизумабв адъювантном режиме снизил риск рецидива на 32% у больных светлоклеточным раком почки промежуточного, высокого риска рецидива и после резекции метастазов.
Назофарингеальная карцинома
В ходе конгресса были представлены результаты III фазы JUPITER-02: исследования эффективности торипалимаба или плацебо в комбинации с гемцитабином и цисплатином в I линии терапии рецидивирующим или метастатическим раком носоготки [3].
Примечание
· Торипалимаб – гуманизированное моноклональное антитело IgG4K, специфичное к PD-1; один из 3-х китайских анти-PD1ингибиторов.
· Торипалимаб продемонстрировал длительный ответ в монотерапии у больных метастатической НФКво II линии (исследование POLARIS-02).
· Рак носоглотки – редкая опухоль и составляет менее одного случая на каждые 100 000 человек в год. В азиатских странах является эндемичным злокачественным новообразованием (3:100 000 человек в год). Рак носоглотки часто диагностируется в запущенной стадии; у пациентов c ранней стадии отмечается высокий риск рецидива после лучевой или химиолучевой терапии.
· В исследование III фазы JUPITER-02 включались пациенты только из азиатских стран.
Результаты
· Медиана ВБП составила 11,7 мес. в группе торипалимаба против 8,0 мес. в группе плацебо (ОР=0,52 [95% ДИ: 0,36-0,74]; р=0,0003);1-годичная ВБП - 49% и 28% соответственно.
· Частота объективных ответов- 77,4% против 66,4% (p=0,033); а медиана длительности ответа – 10,0 мес. против 5,7 мес.(ОР = 0,50 [95% ДИ: 0,33-0,78]) соответственно.
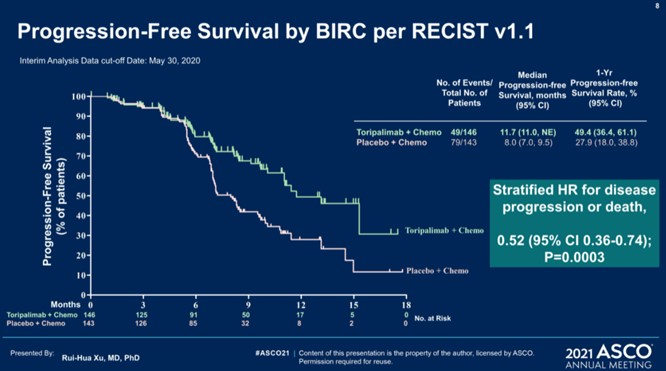
Рисунок 3 – Исследование III фазы JUPITER-02: торипалимаб против плацебо в комбинации с гемцитабином и цисплатином в I линии терапии рецидивирующего или метастатического рака носоглотки [3].
NB! У больных метастатическим раком носоглотки в I линии комбинация нового PD1-ингибитора торипалимаба с гемцитабином и цисплатином превышает эффективность ХТ по показателям ВБП, частоты и длительности ОО.
Рак пищевода
ChauI и соавторы [4] представили результаты CheckMate 648: исследования комбинаций «ниволумаб + ипилимумаб» или «ниволумаб + ХТ» против ХТ в I линии терапии распространенного плоскоклеточного рака пищевода (мПРП)[4].
Примечание
· Первичной конечной точкой исследования являлась ОВ и ВБП у больных с экспрессией PD-L1 ≥ 1%в опухолевых клетках.
Результаты
· При минимальном наблюдении в 13 мес.у пациентов мПРП с PD-L1 экспрессией опухолевых клеток ≥ 1% «ниволумаб + ХТ»против ХТ показали статистически значимое увеличение ОВ. Медиана ОВ составила 15,4 мес. и 9,1 мес. (ОР 0,54 [99,5% ДИ 0,37–0,80]; p<0,0001) соответственно.
· Также наблюдалось статистически значимое преимущество ВБП для больных в группе «ниволумаба + ХТ»против ХТ (ОР 0,65 [98,5% ДИ 0,46–0,92]; p=0,0023). Данные по ВБП в группе «ниволумаб + ипилимумаб» против ХТ не соответствовали заданной границе значимости.
· ЧОО у пациентов с PD-L1 опухолевых клеток ≥ 1%составила 53% («ниволумаб + ХТ»), 35% («ниволумаб + ипилимумаб») и 20% (ХТ);в общей группе пациентов – 47%, 28% и 27% соответственно.
· Более длительная медиана продолжительности ответа наблюдалась для пациентов мПРП с PD-L1 опухолевых клеток ≥ 1%: 95%ДИ 8,4 [6,9–12,4]; 11,8 [7,1–27,4] против 5,7 [4,4–8,7] мес. соответственно.
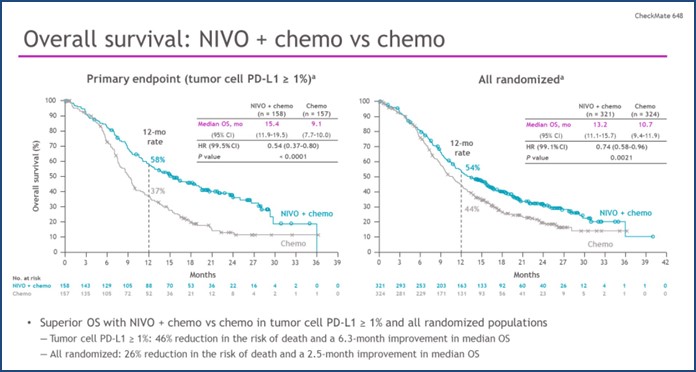
Рисунок 4 – Исследование III фазы CheckMate 648: «ниволумаб + ипилимумаб» или«ниволумаб + ХТ»против ХТ в I линии терапии распространенного плоскоклеточного рака пищевода[4].
NB! Исследователи заключили, что комбинация на основе ниволумаба для больных распространенным плоскоклеточным раком пищевода, ранее не получавших лечения, новый стандарт лекарственного лечения. Так, например, у больных метастатическим плоскоклеточным раком пищевода при использовании в I линии терапии комбинации «ниволумаб + ХТ» в сравнении с ХТ риск смерти в общей популяции больных снижался на 36%; тогда как у больных с PD-L1 экспрессией >1%-на 46% (рис.4).
Рак шейки матки
В ходе конгресса были доложены результаты OUTBACK:исследования АХТ после химиолучевой терапии (ХЛТ) против ХЛТ у больных местнораспространенным раком шейки матки [5].
Примечание
Критериями включения были местнораспространенный рак шейки матки FIGO 2008 стадии IB1 и N+, IB2, II, IIIB или IVA.
Больные были рандомизированы на группы стандартной ХЛТ на основе цисплатина с последующей АХТ по схеме «карбоплатин + паклитаксел» №4 против стандартной ХЛТ.
Результаты
· 5-летняя ОВне различалась в исследуемых группах (72% против 71%; разница <1%; 95% ДИ от -6 до +7; p=0,91) соответственно.
· 5-летняя ВБП также не отличалась (63% против 61%; разница 2%; 95% ДИ от -5 до +9; Р = 0,61).
Токсический профиль
· Нежелательные явления 3-5-й степени в течение года рандомизации наблюдались у 81% в группе АХТ против 62% в группе без АХТ.
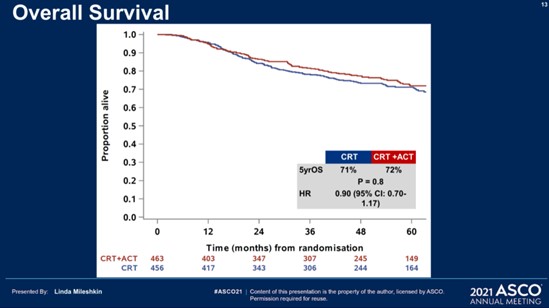
Рисунок 5 – Исследование III фазы OUTBACK: адъювантная химиотерапия после ХЛТ против ХЛТ у больных местнораспространенным раком шейки матки[5].
NB! Добавление 4 циклов АХТ по схеме ТС после химиолучевой терапии не улучшило показатели 5-летней ВБП и ОВ у больных местнораспространенным раком шейки матки.
Немелкоклеточный рак легких
Skoulidis F. и соавторы [6] представили результаты II фазы CodeBreaK 100 исследования соторасиба у предлеченных больных метастатическим немелкоклеточным раком легких (НМРЛ) с мутацией в гене KRASp.G12C [6].
Примечание
Соторасиб одобрен FDA 28 мая 2021 года на основе ранее сообщенных результатов исследования CodeBreaK 100.
Результаты
· ОО достигнут у 46 пациентов (37,1%), в т.ч., 4 полных ответа (3,2%) и 42 частичных ответа (33,9%).
· Медиана ОВ составила 12,5 месяцев, медиана продолжительности ответа – 11,1 месяца, а медиана ВБП – 6,8 месяца.

Рисунок 6 – Исследование II фазы CodeBreaK 100: соторасиб у предлеченных больных метастатическим немелкоклеточным раком легких (НМРЛ) с мутацией в гене KRAS p.G12C[6].
NB! Клиническое преимущество соторасиба наблюдалось во всех подгруппах пациентов мНМРЛ с мутацией в гене KRAS p.G12C.Необходимо генетическое тестирование мутаций в гене в гене KRAS у больных метастатическим немелкоклеточным раком легких.
Меланома
Lipson E. J. и соавторы представили результаты III фазы RELATIVITY–047:исследования комбинации «релатлимаб + ниволумаб» против ниволумаб в I линии терапии распространенной меланомы [7].
Примечание
· Ген активации лимфоцитов 3 (LAG-3) регулирует сигнальный путь, ингибирующий активность Т–клеток. Релатлимаб – человеческое IgG4 LAG-3-блокирующее антитело, которое восстанавливает эффекторную функцию «истощенных» Т-лимфоцитов.
Результаты
· Медиана ВБП в группе «релатлимаб + ниволумаб»была значительно выше и составила 10,1 мес. [95% ДИ, 6,4–15,7] против 4,6 мес. [95% ДИ, 3,4–5,6] в группе ниволумаба (ОР = 0,75 [95% ДИ, 0,6 – 0,9]); p=0,0055.
· 1-годичная ВБП – 47,7% (95% ДИ [41,8–53,2]) против 36,0% (95% ДИ [30,5–41,6]) соответственно.
Токсический профиль
· Частота нежелательных явлений 3–4 степени, связанных с лечением, была выше в группе «релатлимаб + ниволумаб» (18,9%) против группы ниволумаба (9,7%).
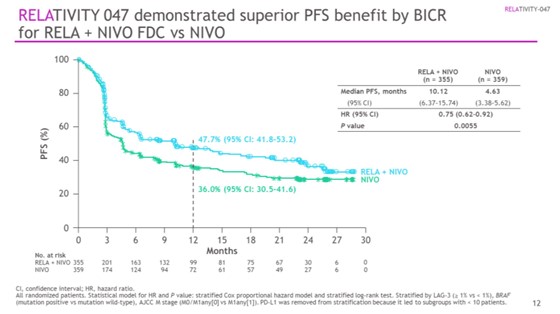
Рисунок 7 – Исследование III фазы RELATIVITY–047: «релатлимаб + ниволумаб» противниволумаб в I линии терапии распространенной меланомы [7].
NB! RELATIVITY–047 –первое исследование III фазы, демонстрирующее клинически значимую пользу от двойного ингибирования путей LAG-3 и PD-1. Комбинация «релатлимаб + ниволумаб» в I линии терапии продемонстрировала статистически значимое преимущество ВБП против монотерапи иниволумабом у пациентов распространенной меланомой.
Дорогие коллеги! Продолжим обсуждение на «Белых ночах» 2021!
Источники:
1. Tutt A., Garber J. E., Kaufman B. et al. OlympiA: A phase III, multicenter, randomized, placebo-controlled trial of adjuvant olaparib after (neo)adjuvant chemotherapy in patients with germline BRCA1/2 mutations and high-risk HER2-negative early breast cancer.J ClinOncol 39, 2021 (suppl 15; abstr LBA1).DOI:10.1200/JCO.2021.39.15_suppl.LBA1.
2. Choueiri T. K., Tomczak P., Park S.H.et al. Pembrolizumab versus placebo as post-nephrectomy adjuvant therapy for patients with renal cell carcinoma: Randomized, double-blind, phase III KEYNOTE-564 study.J ClinOncol 39, 2021 (suppl 15; abstr LBA5). DOI:10.1200/JCO.2021.39.15_suppl.LBA5.
3.Xu R., Mai H.–Q., ChenQ.–Y. et al. JUPITER-02: Randomized, double-blind, phase III study of toripalimab or placebo plus gemcitabine and cisplatin as first-line treatment for recurrent or metastatic nasopharyngeal carcinoma (NPC).J ClinOncol 39, 2021 (suppl 15; abstr LBA2).DOI:10.1200/JCO.2021.39.15_suppl.LBA2.
4.ChauI., Doki Y., Ajani J. A et al. Nivolumab (NIVO) plus ipilimumab (IPI) or NIVO plus chemotherapy (chemo) versus chemo as first-line (1L) treatment for advanced esophageal squamous cell carcinoma (ESCC): First results of the CheckMate 648 study.J ClinOncol 39, 2021 (suppl 15; abstr LBA4001). DOI:10.1200/JCO.2021.39.15_suppl.LBA4001.
5.Mileshkin L. R., Moore K. N., Barnes E., et al. Adjuvant chemotherapy following chemoradiation as primary treatment for locally advanced cervical cancer compared to chemoradiation alone: The randomized phase III OUTBACK Trial (ANZGOG 0902, RTOG 1174, NRG 0274).J ClinOncol 39, 2021 (suppl 15; abstr LBA3).DOI:10.1200/JCO.2021.39.15_suppl.LBA3.
6.Skoulidis F., Li B. L., Govindan R. et el.Overall survival and exploratory subgroup analyses from the phase 2 CodeBreaK 100 trial evaluating sotorasib in pretreated KRAS p.G12C mutated non-small cell lung cancer.J ClinOncol 39, 2021 (suppl 15; abstr 9003).DOI:10.1200/JCO.2021.39.15_suppl.9003.
7. Lipson E. J., Abdul-Hassan T. H., Schadendorf D.J. et al. Relatlimab (RELA) plus nivolumab (NIVO) versus NIVO in first-line advanced melanoma: Primary phase III results from RELATIVITY-047 (CA224-047).ClinOncol 39, 2021 (suppl 15; abstr 9503). DOI:10.1200/JCO.2021.39.15_suppl.9503.
