"Генная" терапия была одобрена FDA для лечения острой лимфобластной лейкемии
30 августа 2017 года произошло историческое событие, которого все мы так долго ждали: FDA одобрили первую «генную» терапию, разработанную компанией Novartis для лечения различных онкологических заболеваний.
 «Получив
возможность репрограммирования собственных клеток пациента для борьбы с раком, мы вступили в
новую эпоху медицинских технологий», комментирует данное событие представитель FDA Scott
Gottlieb, MD, «генная и клеточная терапия обладают мощным потенциалом, возможностью
развития кардинальных перемен в лечении ранее инкурабельных больных».
«Получив
возможность репрограммирования собственных клеток пациента для борьбы с раком, мы вступили в
новую эпоху медицинских технологий», комментирует данное событие представитель FDA Scott
Gottlieb, MD, «генная и клеточная терапия обладают мощным потенциалом, возможностью
развития кардинальных перемен в лечении ранее инкурабельных больных».
Kymriah (tisagenlecleuce) был одобрен FDA для лечения острой лимфобластной лейкемии в группе пациентов до 25 лет, уже получивших одну или две линии терапии.
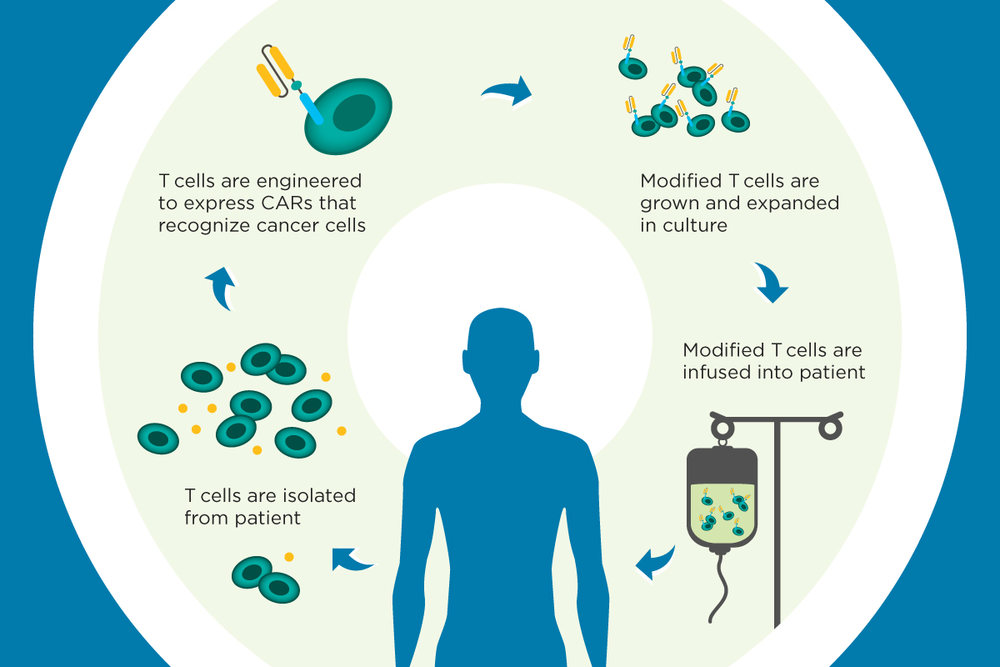
Kymriah является генетически модифицированной аутологичной Т-клеточной иммунотерапией. Собственные Т-клетки пациента, после генетической модификации с включением рецептора химерного антигена (chimeric antigen receptor или CAR) в лаборатории, вновь возвращаются пациенту посредством реинфузии. CAR-T клетки целенаправленно «атакуют» опухолевые клоны, содержащие на своей поверхности антиген CD19.
Безопасность и эффективность Kymriah была продемонстрирована в мультицентровом клиническом исследовании с включением 63 пациентов до 25 лет с рецидивом B-клеточного острого лимфобластного лейкоза или рефрактерностью к предшествующей терапии. Ремиссия в течении 3 месяцев была достигнута в 83 % случаев.
 Данная
терапия часто ассоциирована с синдромом высвобождения цитокинов (cytokine release syndrome-CRS)
являющимся систематическим ответом на активацию и пролиферацию CAR-T клеток. Основными
проявлениями CRS являются лихорадка, различные неврологические и гриппоподобные симптомы,
которые могут быть жизнеугрожающими.
Данная
терапия часто ассоциирована с синдромом высвобождения цитокинов (cytokine release syndrome-CRS)
являющимся систематическим ответом на активацию и пролиферацию CAR-T клеток. Основными
проявлениями CRS являются лихорадка, различные неврологические и гриппоподобные симптомы,
которые могут быть жизнеугрожающими.
Развитие инфекций (Kymriah разрушает здоровые B-лимфоциты, имеющие антиген CD19) гипотония, гипоксия, острая почечная недостаточность также наблюдались при применении терапии. Наиболее часто нежелательные явления развивались с 2 дня по 22 день после реинфузии.
Чтобы снизить риск развития CRS, вместе с Kymriah FDA продлили лицензию для препарата Actemra (toclizumab) для пациентов старше 2 лет.
Для дальнейшей оценки безопасности и эффективности в группе пациентов, получивших лечение Kymriah, запланированы дальнейшие постмаркетинговые исследования.
Подробнее: https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm574058.htm
Материал подготовлен: Харченко Евгения Владимировна
