Мелатонин в лекарственном лечении больных различными злокачественными опухолями
В последнее время активно изучается противоопухолевая активность гормона эпифиза мелатонина. Этой теме посвящены многочисленные опыты in vitro/in vivo, в которых показана способность мелатонина тормозить злокачественный рост и потенцировать действие цитостатиков [1–6]. Механизм противоопухолевого действия мелатонина до конца не изучен (рис.1). Известны некоторые возможные аспекты торможения опухолевого роста мелатонином – активация Т-хелперов 1 типа и увеличение продукции ряда цитокинов (IL-2, IFN-γ, интерлейкина-6)[7,8], снижение экспрессии VEGF рецептора [9], активацией апоптоза в опухолевых клетках [10-13], уменьшение активности теломеразы [14]. Все большее внимание также уделяется применению мелатонина в клинических исследованиях с целью повышения эффективности лекарственного лечения у пациентов с различными злокачественными опухолями, в том числе посредством подавления метаболической иммуносупрессии. [15]
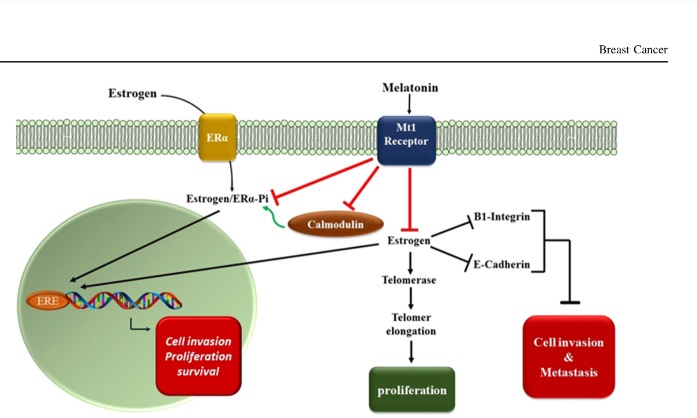
Рисунок 1. Противоопухолевый механизм действия мелатонина в клетках рака молочной железы [Nooshinfar E., 2016].
В обзорной статье в журнале «Злокачественные опухоли» представлены данные о применении мелатонина в лечении 3177 пациентов с различными солидными опухолями. Авторами был проведен анализ 17–ти оригинальных исследований, в 14–ти из которых была проведена оценка эффективности лечения (табл.1). Большинство из исследований включенных в анализ являлись проспективными и рандомизированными, в которых пациенты были распределены на группы, получающие стандартное лечение с добавлением мелатонина или без него. Мелатонин применялся как в монотерапии, так и в комбинации с различными методами лекарственного лечения: гормонотерапией, иммунотерапией или химиотерапией. Согласно результатам исследований применение мелатонина приводило к увеличению объективных ответов и/или общей выживаемости пациентов, а также сопровождалось к снижением частоты побочных эффектов лекарственной противоопухолевой терапии. [15]
Таблица 1 – Метаанализ эффективности мелатонина в лечении различных злокачественных опухолей (n=3177) [15].
Автор, год |
Локализация опухоли |
Режим с МЛТ |
n |
Режим без МЛТ |
n |
Объективный ответ,% |
Выживаемость (общая, безрецидивная) |
|||||
С МЛТ |
Без МЛТ |
р |
Показатель |
С МЛТ |
Без МЛТ |
р |
||||||
Монотерапия мелатонином |
||||||||||||
Lissoni, 1992, [16] |
НМРЛ |
Поддерживающая терапия + МЛТ |
31 |
Поддерживающая терапия |
32 |
35 |
9 |
<0.01 |
1лОВ, % |
8 |
2 |
<0.05 |
Lissoni, 1994, [17] |
КРР, РМЖ, НМРЛ, ПКР, саркома, меланома |
Поддерживающая терапия + МЛТ |
24 |
Поддерживающая терапия |
26 |
- |
- |
- |
1лОВ, % |
37.5 |
11 |
<0.05 |
Lissoni, 2002, [18] |
НМРЛ, РМЖ, КРР, РПЖ, ГЦР, РЖ, ОГШ, саркомы, ПКР, меланома, РШМ, холангиокарцинома,рак РПРЖ,РЯ, герминогенные опухоли, эндометриодный рак, РМП |
Поддерживающая терапия + МЛТ |
722 |
Поддерживающая терапия |
718 |
23,5 |
7,5 |
<0.001 |
1лОВ, % |
- |
- |
<0.05 |
Lissoni, 2008, [19] |
НМРЛ, РЖ, РПЖ, ГЦР, холангиокарциномой, КРР |
Поддерживающая терапия + МЛТ |
285 |
Поддерживающая терапия |
286 |
35 |
6 |
<0.05 |
1лОВ, % 2лОВ, % |
22 2 |
10 0 |
<0.05 |
Ермаченков, 2013, [20] |
РЖ КРР |
МЛТ |
57 47 |
- |
175 175 |
- |
- |
- |
2,5лОбВ%(РЖ) 2,5лОбВ%(КРР) |
70 72
|
43 58 |
<0.05 <0.05 |
Мелатонин совместно с гормонотерапией или химиотерапией |
||||||||||||
Lissoni, 1995, [21] |
РМЖ |
Т + МЛТ |
19 |
Т |
21 |
36 |
9,5 |
<0.05 |
1лОВ, % |
63 |
23 |
<0.01 |
Lissoni, 1997, [22] |
НМРЛ |
ЕР + МЛТ |
34 |
ЕР |
36 |
32 |
17 |
>0.05 |
1лОВ, % |
44 |
19 |
<0.05 |
Lissoni, 1999, [23] |
КРР, РЖ, ОГШ, РМЖ |
ЕР, МТ, ПТ, ГЦ, ДР, 5 ФУ + МЛТ |
124 |
ЕР,МТ,ПТ,ГЦ,ДР, 5 Ф. |
126 |
34 |
15 |
<0.01 |
1лОВ, % |
51 |
23 |
<0.01 |
Lissoni, 2002, [24] |
РЖ, НМРЛ, КРР, мягкотканные саркомы, |
ЕР, ТС, ГТ, Р, 5ФУ, И, ECF + МЛТ |
98 |
ЕР,ТС,ГТ,Р,5ФУ,И,PFE |
102 |
77 |
55 |
<0.05 |
1лОВ, % |
- |
- |
<0.05 |
Yan, 2002, [25] |
ГЦР |
ТАХЭ + МЛТ |
50 |
ТАХЭ |
50 |
28 |
16 |
<0.05 |
1лОВ, % 2лОВ, % |
68 40 |
54 26 |
<0.05 <0.05 |
Gerea, 2003, [26] |
КРР |
И + МЛТ |
14 |
И |
16 |
86 |
33 |
<0.05 |
1лОВ, % |
- |
- |
- |
Lissoni, 2007, [27] |
НМРЛ, РЖ, КРР |
ЕР, ECF, FOLFOX |
187 |
ЕР, ECF, FOLFOX |
183 |
73 |
50 |
<0.01 |
2лОВ, % |
25 |
13 |
<0.05 |
Новик, 2015, [28] |
Меланома |
Д + МЛТ |
|
Д |
|
Исследование не завершено |
||||||
Мелатонин совместно с иммунотерапией
|
||||||||||||
Lissoni, 1994, [29] |
НМРЛ, КРР, ГЦР, РЖ, РПЖ, РМЖ |
IL-2 + МЛТ |
41 |
IL-2 |
39 |
26 |
3 |
<0.001 |
1лОВ, % |
46 |
15 |
<0.05 |
Lissoni, 2000, [30] |
ПКР |
IL-2 + МЛТ |
14 |
IL-2 |
16 |
28 |
6 |
<0.05 |
2л ОВ, % |
- |
- |
<0.01 |
Примечание:
НМРЛ - немелкоклеточный рак легкого, КРР – колоректальный рак, РМЖ – рак молочной железы, РЖ- рак желудка, ГЦР – гепатоцеллюлярный рак, РПЖ – рак поджелудочной железы, ПКР – почечноклеточный рак, ОГШ – опухоли головы и шеи, РШМ – рак шейки матки, РПРЖ – рак предстательной железы, РМП – рак мочевого пузыря, РЯ – рак яичников, Т – тамоксифен, ЕР – цисплатин + этопозид, МТ – митоксантрон, 5ФУ – 5 фторурацил +лейковрин, ПТ - паклитаксел, ГЦ- гемцитабин, ДР – доксорубицин, ТС - цисплатин + паклитаксел, ГТ – гемцитабин + цисплатин, Р – ралтитрексед, И – ифосфамид, ECF – цисплатин+эпирубицин + 5 фторурацил, ТАХЭ – трансартериальная химиоэмболизация, И – иринотекан, Д - дакарбазин, FOLFOX – оксалиплатин + 5 Фторурацил + лейковорин.
По мнению авторов для внедрения в рутинную клиническую практику мелатонина как лекарственного средства в составе комплексной терапии злокачественных опухолей требуется более глубокое его изучение в рамках клинических исследований.
В настоящее время в НИИ онкологии им. Н.Н. Петрова проходят 3 клинических исследований по изучению эффективности метформина, инициированные Институтом в рамках научно-исследовательской работы и зарегистрированные в международной базе клинических исследований: «Многоцентровое открытое рандомизированное исследование II фазы по оценке применения дакарбазина в сочетании с мелатонином или метформином по сравнению с монотерапией дакарбазином в качестве 1 линии терапии диссеминированной меланомы кожи» (ClinicalTrials.gov Identifier: NCT02190838) [31], «Многоцентровое открытое рандомизированное проспективное клиническое исследование по оценке эффективности неоадъювантной химиотерапии с метформином или мелатонином у больных местно-распространенным раком молочной железы» (ClinicalTrials.gov Identifier: NCT02506777) [32] и «Многоцентровое открытое рандомизированное проспективное клиническое исследование по оценке эффективности неоадъювантной гормонотерапии торемифеном с метформином или мелатонином у больных местно-распространенным раком молочной железы» (ClinicalTrials.gov Identifier: NCT02506790) [33].
Список литературы:
- Анисимов В.Н., Морозов В.Г., Хавинсон В.Х., Дильман В.М. Сопоставление противоопухолевой активности экстрактов эпифиза, гипоталамуса, мелатонина и сигетина у мышей с перевитым раком молочной железы // Вопр. онкол. – 1973. - № 10. – С. 99-101.
- Мусатов С.А., Розенфельд С.В., Того У.Ф. и др. Влияние мелатонина на мутагенность и противоопухолевый эффект цитостатиков у мышей // Вопр. онкол. – 1997. – t. 44. - № 6. – С. 623-626.
- Осипов М.А., Попович И.Г., Анисимов В.Н. и др. оценка влияния разных доз и схем введения доксорубицина в сочетании с МЛТ на модели перевиваемой опухоли Эрлиха у самок мышей sHR // Злокачественные опухоли. – 2014. - № 3. – С. 285.
- Попович И.Г., Панченко А.В., Тындык М.Л. и др. Влияние противоопухолевых препаратов и их комбинаций с мелатонином на рост перевиваемой опухоли молочной железы с инкорпорированным геном HeR 2/ neu у самок мышей FBV // Материалы VII съезда онкологов и радиологов СнГ и евразии. – Казань, 2014. – С. 116.
- Anisimov V.N., Alimova I.N., Yashin A.I. Dose dependent effect of melatonin on life span and spontaneous tumor incidence in female sHR mice // exp. Gerontol. – 2003. - Vol. 38 (4). – P. 449-461.
- Anisimov V.N., Zabezhinski M.A., Popovich I.G. et al. Inhibitory effect of melatonin on 7,12 – dymethylbenz(a) anthracene – induced carcinogenesis of the uterine cervix and vagina in mice and mutagenesis in vitro // Cancer Lett. – 2000. - Vol. 156. – P. 199-205.
- Kidd P. Th1/th2 balance: The hypothesis, its limitations, and implications for health and disease//Altern Med Rev. - 2003.-V.8-I.3-P.223-246.
- Miller S. C., Pandi-Perumal S. R., Esquifino A. I. et al. The role of melatonin in immuno-enhancement: Potential application in cancer//Int J Exp Pathol.- 2006.-V.87-I.2-P.81-87.
- Jardim-Perassi B., Ali S. Arbab, Ferreira L. et al. Effect of Melatonin on Tumor Growth and Angiogenesis in Xenograft Model of Breast Cancer // PLoS One. 2014; 9(1): e85311.
- Paroni R., Terraneo L., Bonomini F. Antitumor activity of melatonin in a mouse model of human prostate cancer: relationship with hypoxia signaling // J. Pineal Res. – 2014. – 57. – Vol.57. – P.43-52.
- Wang J., Xiao X., Zhang Y. et al. Simultaneous modulation of COX-2, p300, Akt, and Apaf-1 signaling by melatonin to inhibit proliferation and induce apoptosis in breast cancer cells // J. Pineal Res. – 2012. – Vol.53(1). – P.77-90.
- Chuffa L., Alves M., Martinez M. et al. Apoptosis is triggered by melatonin in an in vivo model of ovarian carcinoma // Endocr. Relat. Cancer. – 2015. Nov 10. pii: ERC-15-0463.
- Xi S.C., Siu S.W., Fong S.W., Shiu SY. Inhibition of androgen-sensitive LNCaP prostate cancer growth in vivo by melatonin: association of antiproliferative action of the pineal hormone with mt1 receptor protein expression // Prostate – 2001. – Vol.46(1). – P.52-61.
- Leon Blanco M., Guerrero J., Reiter R. et al. Melatonin inhibits telomerase activity in the MCF-7 tumor cell line both in vivo and in vitro // J. Pineal Res. – 2003. – Vol.35. – P. 204-
- Семиглазова Т.Ю., Осипов М.А., Новик А.В., Клименко В.В., Анисимов В.Н. Перспективы использования мелатонина в клинической онкологии // Злокачественные опухоли. – 2016. - №4. – С.21-29.
- Lissoni P., Barni S., Ardizzoia A. Randomized study with the pineal hormone melatonin versus supportive care alone in advanced non small cell lung cancer resistant to a first-line chemotherapy containing cisplatin // Oncology. – 1992. – Vol.49(5). – P.336-9.
- Lissoni P., Barni S., Ardizzoia A. A randomized study with the pineal hormone melatonin versus supportive care alone in patients with brain metastases due to solid neoplasms // Cancer. – 1994. – Vol.73(3). – P.699-701.
- Lissoni P. Is there a role for melatonin in supportive care? // Support. Care Cancer – 2002. – Vol.10(2). – P.110-6.
- Lissoni P., Brivio F., Fumagalli L. Neuroimmunomodulation in medical oncology: application of psychoneuroimmunology with subcutaneous low-dose IL-2 and the pineal hormone melatonin in patients with untreatable metastatic solid tumors // Anticancer Res. – 2008. – Vol.28(2B). – P.1377-81.
- Ермаченков М.Н. Влияние мелатонина на течение рака желудка и толстой кишки // автореф. дисс. кандидата мед. наук., Санкт-Петербург. – 2013. – 22 с.
- Lissoni P. et al. Modulation of cancer endocrine therapy by melatonin: a phase II study of tamoxifen plus melatonin in metastatic breast cancer patients progressing under tamoxifen alone // Br. J Cancer. - 1995. - Vol. 71(4). - P.854-856.
- Lissoni P., Paolorossi F., Ardizzoia A. et al. A randomized study of chemotherapy with cisplatin plus etoposide versus chemoendocrine therapy with cisplatin, etoposide and the pineal hormone melatonin as a first-line treatment of advanced non-small cell lung cancer patients in a poor clinical state // J. Pineal Res. - 1997. - Vol. 23. - Р.15–19.
- Lissoni P., Chilelli M., Villa S. et al. Five years survival in metastatic non-small cell lung cancer patients treated with chemotherapy alone or chemotherapy and melatonin: a randomized trial // J. Pineal. Res. - 2003. - Vol. 35. - Р. 12–15.
- Lissoni P, Barni S, Mandalà M Decreased toxicity and increased efficacy of cancer chemotherapy using the pineal hormone melatonin in metastatic solid tumour patients with poor clinical status // Eur. J. Cancer. – 1999. – Vol.35(12). – P.1688-92.
- Yan J., Shen F., Wang K., Wu M. Patients with advanced primary hepatocellular carcinoma treated by melatonin and transcatheter arterial chemoembolization: a prospective study // Hepatobiliary Pancreat. Dis. Int. – 2002. – Vol.1(2). – P.183-6.
- Cerea G., Vaghi M., Ardizzoia A. et al. Biomodulation of cancer chemotherapy for metastatic colorectal cancer: a randomized study of weekly low – dose irinotecan alone versus irinotecan plus the oncostatic pineal hormone melatonin in metastatic colorectal cancer patients progressing on 5 – fluorouracil – containing combanations // Anticancer res. – 2003. – Vol. 23(2c). – P.1951 – 1954.
- Lissoni P. Biochemotherapy with standard chemotherapies plus the pineal hormone melatonin in the treatment of advanced solid neoplasms // Pathol Biol (Paris) - 2007. – Vol.55 (3-4). – P.201-4.
- Новик А.В., Проценко С.А., Балдуева И.А., и др. Первые результаты клинической эффективности применения мелатонина и метформина у больных диссеминированной меланомой кожи, получающих первую линию системной терапии дакарбазином // Вопр. Онкологии. – 2016. – Т.62, №2. – С.324-329.
- Lissoni P., Brivio F., Barni S. Neuroimmunotherapy of human cancer with interleukin-2 and the neurohormone melatonin: its efficacy in preventing hypotension // Anticancer Res. – 1990. – Vol.10(6). – P.1759-61.
- Lissoni P., Barni S., Tancini G. et al. A randomised study with subcutaneous low-dose interleukin 2 alone vs interleukin 2 plus the pineal neurohormone melatonin in advanced solid neoplasms other than renal cancer and melanoma // Br. J. Cancer. – 1994. – Vol.69(1). – P.196-9.
- Comparison of Melatonin or Metformin and Dacarbazine Combination Versus Dacarbazine Alone in Disseminated Melanoma // ClinicalTrials.gov Identifier: NCT02190838
- Neoadjuvant FDC With Melatonin or Metformin for Locally Advanced Breast Cancer // ClinicalTrials.gov Identifier: NCT02506777
- Neoadjuvant Toremifene With Melatonin or Metformin in Locally Advanced Breast CancerClinicalTrials.gov Identifier: NCT02506790
Материал подготовил Михаил Анатольевич Осипов, лаборант-исследователь Научного отдела инновационных методов терапевтической онкологии и реабилитации.
