Метформин в лекарственном лечении злокачественных опухолей
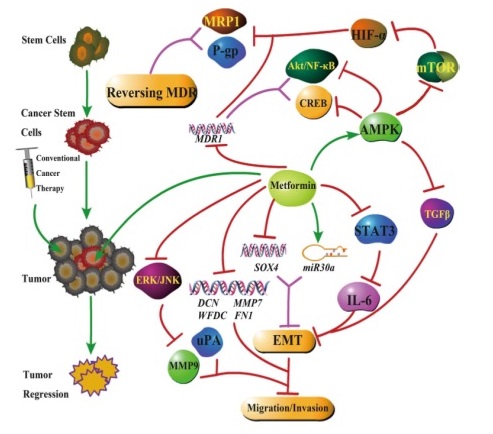
Интерес к метформину, как к препарату для возможного использования в онкологии в последнее десятилетие растет. Это связано в первую очередь с многообещающими результатами опытов in vitro/in vivo, в которых этот бигуанид показал выраженную противоопухолевую активность [1]. Центральным звеном в противоопухолевой активности метформина является его способность активировать циклическую аденозин-монофосфатзависимую протеинкиназу (АМФК) [2], одного из главных ферментов регуляторов энергообеспечения и деления клеток, которая в свою очередь ингибирует активность M-TOR - центрального регулятора синтеза белка и клеточного роста [3]. Метформин может снижать уровень глюкозы, повышенное потребление глюкозы опухолевыми клетками и уменьшать уже давно известный эффект Варбурга [4]. Это приводит также к снижению уровня инсулина, что существенно затрагивает систему инсулиноподобного фактора роста, который рассматривается в настоящее время как одна из основных мишеней для таргетной терапии [5].
Данные эпидемиологических исследований подтверждают влияние метформина на снижение заболеваемости злокачественными опухолями у пациентов с сахарным диабетом (СД), принимающих данный препарат [6-8].
В метаанализ, опубликованный в декабрьском номере журнала Annals of Oncology, были включены результаты 23-х статей и 4–х абстрактов, а также данные о более чем 20 тысячах (n=24.178) больных злокачественными опухолями (табл. 1) [9].
Таблица 1 – Метаанализ исследований (n=24.178) эффективности метформина в адъювантном лечении различных злокачественных опухолей.
Диагноз |
Стадия |
Число работ |
Общее количество пациентов |
Число пациентов, получавших метформин |
Медиана наблюдения (мес.) |
Ссылка |
КРР |
I - III |
5 |
1936 |
1153 |
41 - 78 |
[10-14] |
РПЖ |
I - II |
8 |
12583 |
2215 |
25 - 100 |
[15-21] |
РМЖ |
I - III |
3 |
2045 |
1007 |
57 - 87 |
[22-24] |
РМП |
I - II |
3 |
4747 |
317 |
34 - 64 |
[25-27] |
ОГШ |
I - II |
2 |
1150 |
132 |
44 - 65 |
[28-29] |
ПКР |
I - II |
2 |
984 |
138 |
41 - 97 |
[30-31] |
РПдЖ |
I - III |
1 |
44 |
19 |
- |
[32] |
РТМ |
I - IV |
1 |
363 |
200 |
33 |
[33] |
РЖ |
I - III |
1 |
326 |
132 |
74 |
[34] |
НМРЛ |
I – II |
1 |
- |
- |
- |
[35] |
Примечание: КРР – колоректальный рак, РПЖ – рак предстательной железы, РМЖ – рак молочной железы, РМП – рак мочевого пузыря, ОГШ – плоскоклеточный рак головы и шеи, ПКР – почечноклеточный рак, РПдЖ – рак поджелудочной железы, РТМ – рак тела матки, РЖ – рак желудка, НМРЛ - немелкоклеточный рак легкого
В большинстве работ [9] ретроспективно оценивались отдаленные результаты радикального лечения пациентов со злокачественными опухолями, получавших метформин по поводу СД II типа и не получавших метформин (безрецидивная и общая выживаемость). Использование метформина приводило к статистически значимому увеличению безрецидивной (ОР 0.63, 95% ДИ 0.47 – 0.85) и общей выживаемости (ОР 0.69, 95% ДИ 0.58 – 0.83) у пациентов с колоректальным раком [10-14]. У больных ранним раком предстательной железы использование метформина также ассоциировалось с увеличением безрецидивной (ОР 0.83, 95% ДИ 0.69-1.00) и общей выживаемости (ОР 0.82, 95% ДИ 0.73-0.93) [15-21]. Наилучшие результаты безрецидивной выживаемости с метформином были получены у пациентов, которые в качестве радикального лечения по поводу рака предстательной железы получили лучевую терапию (ОР 0.45, 95% ДИ 0.29-0.70) [18,20].
Не было отмечено преимуществ в безрецидивной и общей выживаемости при использовании метформина после радикального лечения пациентов с раком молочной железы [22-24] и уротелиальной карциномой [25-27]. Авторы также отмечают, что в исследованиях, включенных в метаанализ, недостаточно данных о дозировке метформина и длительности его приема [9].
Таким образом, использование метформина у пациентов после радикального лечения колоректального рака и рака предстательной железы является перспективным, однако требует дельнейшего изучения в рамках рандомизированных проспективных исследований.
В настоящее время в НИИ онкологии им. Н.Н. Петрова проходят 3 клинических исследований по изучению эффективности метформина, инициированные Институтом в рамках научно-исследовательской работы и зарегистрированные в международной базе клинических исследований: «Многоцентровое открытое рандомизированное исследование II фазы по оценке применения дакарбазина в сочетании с мелатонином или метформином по сравнению с монотерапией дакарбазином в качестве 1 линии терапии диссеминированной меланомы кожи» [36], «Многоцентровое открытое рандомизированное проспективное клиническое исследование по оценке эффективности неоадъювантной химиотерапии с метформином или мелатонином у больных местно-распространенным раком молочной железы» [37] и «Многоцентровое открытое рандомизированное проспективное клиническое исследование по оценке эффективности неоадъювантной гормонотерапии торемифеном с метформином или мелатонином у больных местно-распространенным раком молочной железы» [38].
Список литературы:
- В.Н. Анисимов, И.Г. Попович, П.А. Егормин, М.Л. Тындык, М.Н. Юрова, М.А. Осипов Перспективы применения антидиабетических бигуанидов для профилактики и лечения рака: результаты доклинических исследований // Вопр. Онкологии. – 2016. – Т.62, №2. – С.234-245.
- Zhou G., Myers R., Li Y. et al. Role of AMPactivated protein kinase in mechanism of metformin action // J. Clin. Invest. – 2001. – Vol.108(8). – P.11671174.
- Shackelford D., Shaw R. The LKB1AMPK pathway: metabolism and growth control in tumour suppression // Nat. Rev. cancer. – 2009. – Vol/9(8). – P.56375.
- Pierotti M. A., Berrino F., Gariboldi M. et al. Targeting metabolism for cancer treatment and prevention: Metformin, an old drug with multi-faceted effects // Oncogene. – 2013. –V.32-I.12. – P.1475-1487.
- Pollak M. Metformin and other biguanides in oncology: advancing the research agenda // Cancer Prev Res (Phila). – 2010. – Vol. 3(9). – P.1060–1065.
- Берштейн Л.М. Антидиабетический бигуанид метформин и онкологическая заболеваемость // Сахарный Диабет. – 2010. - №3. – С.45-48.
- Берштейн Л.М. Неоднозначность данных об эффективности метформина как средства, снижающего массу тела и предотвращающего опухолевый рост: причины и следствия // Ожирение и метаболизм. – 2012. - №2. – С.10-15.
- Berstein L. Metformin in obesity, cancer and aging: addressing controversies // Aging. – 2012. – Vol.4(5). – P.320-329.
- Coyle C., Cafferty F., Vale C., Langley R. Metformin as an adjuvant treatment for cancer: a systematic review and meta-analysis // Ann. of Oncol. - 2016. – Vol.27. – P.2184–2195.
- Spillane S., Bennett K., Sharp L., Barron T. A cohort study of metformin exposure and survival in patients with stage I–III colorectal cancer // Cancer Epidemiol Biomarkers Prev. – 2013. – Vol.22. – P.1364–1373.
- Lee G., Lim K., Tan W. et al. Examining the effects of metformin on survival outcome in stage II/III colorectal cancer patients with diabetes mellitus // J Clin Oncol. - 2012. Vol.30. – abstr.3589.
- Lee J., Kim T., Jeon S. et al. The effects of metformin on the survival of colorectal cancer patients with diabetes mellitus // Int J Cancer. – 2012. – Vol.131. – P.752–759.
- Singh P., Shi Q., Foster N. et al. Relationship between metformin use and recurrence and survival in patients (pts) with resected stage III colon cancer (CC) receiving adjuvant chemotherapy - Results from NCCTG N0147 (Alliance) // ASCO Meeting.- Abstr. – 2015. Vol.33. – P.3531.
- Zanders M., van Herk-Sukel M., Vissers P. et al. Are metformin, statin and aspirin use still associated with overall mortality among colorectal cancer patients with diabetes if adjusted for one another? // Br J Cancer. – 2015. – Vol.113. – P.403–410.
- Allott E., Abern M., Gerber L. et al. Metformin does not affect risk of biochemical recurrence following radical prostatectomy: results from the SEARCH database // Prostate Cancer Prostatic Dis. – 2013. – Vol.16. – P.391–397.
- Kaushik D, Karnes R., Eisenberg M. et al. Effect of metformin on prostate cancer outcomesafterradicalprostatectomy // Urol. Oncol. – 2014. - Vol.32. – P.41–43.
- Rieken M., Kluth L., Xylinas E. et al. Association of diabetes mellitus and metformin use with biochemical recurrence in patients treated with radical prostatectomy for prostate cancer // World J. Urol. – 2014. – Vol.32. – P.999–1005.
- Spratt D., Zhang C., Zumsteg Z. et al. Metformin and prostate cancer: reduced development of castration-resistant disease and prostate cancer mortality // Eur. Urol. – 2013. – Vol.63. – P.709–716.
- Margel D, Urbach D., Lipscombe L. et al. Metformin use and all-cause and prostate cancer-speci?c mortality among men with diabetes // J Clin Oncol. – 2013. – Vol.31. – P. 3069–3075.
- Zannella V., Dal Pra A., Muaddi H. et al. Reprogramming metabolism with metformin improves tumor oxygenation and radiotherapy response // Clin Cancer Res. – 2013. – Vol. 19. –P. 6741–6750.
- Danzig M., Kotamarti S.,Ghandour R. et al. Synergism between metformin and statins in modifying the risk of biochemical recurrence following radical prostatectomy in men with diabetes // Prostate Cancer Prostatic Dis. – P.2015. – Vol.18. – P.63–68.
- Oppong B., Pharmer L., Oskar S. et al. The effect of metformin on breast cancer outcomes in patients with type 2 diabetes // Cancer Med. – 2014. – Vol.3. – P.1025–1034.
- Bayraktar S., Hernadez-Aya L., Lei X. et al. Effect of metformin on survival outcomes in diabetic patients with triple receptor-negative breast cancer // Cancer. – 2012. – Vol.118. – P.1202–1211.
- Lega I., Austin P., Gruneir A. et al. Association between metformin therapy and mortality after breast cancer: a population-based study // Diabetes Care. – 2013. – Vol.36. – P.3018–3026.
- Rieken M., Xylinas E., Kluth L. et al. Association of diabetes mellitus and metformin use with oncological outcomes of patients with non-muscle-invasive bladder cancer // B J U Int. – 2013. – Vol.112. – P.1105–1112.
- Rieken M., Xylinas E., Kluth L. et al. Effect of diabetes mellitus and metformin use on oncologic outcomes of patients treated with radical cystectomy for urothelial carcinoma // Urol Oncol. – 2014. – Vol.32(49).e7–49.e14.
- Rieken M., Xylinas E., Kluth L. et al. Diabetes mellitus without metformin intake is associated with worse oncologic outcomes after radical nephroureterectomy for uppertract urothelial carcinoma // Eur J Surg Oncol. – 2014. – Vol.40. – P.113–120
- Kwon M., Roh J., Song J. et al. Effect of metforminon progression of headand neck cancers, occurrence of second primary cancers, and cause-speci?c survival // Oncologist. – 2015. – Vol.20. – P.546–553.
- Thompson C., Wang M., Sanaiha Y. et al. An analysis of the potential bene?ts of metformin on disease recurrence in oral and oropharyngeal squamous cell carcinoma // J Cancer Ther. – 2013. – Vol.4. – P.961–965
- Hakimi A., Chen L., Kim P. et al. The impact of metformin use on recurrence and cancer-speci?c survival in clinically localized high-risk renal cell carcinoma // Can Urol Assoc J. – 2013. – Vol.7. E687–E691.
- Psutka S., Boorjian S., Lohse C. et al. The association between metformin use and oncologic outcomes among surgically treated diabetic patients with localized renalcellcarcinoma // Urol Oncol. – 2015. – Vol.33:67e15–67e23.
- Ambe C., Mahipal A., Fulp W. Effect of metformin use on the survival outcomes in diabetic patients with resectable pancreatic cancer: a single-institutional experienceandmeta-analysis // ASCO Meeting Abstr. – 2015. Vol.33. – P.465.
- Ko E., Walter P., Jackson A. et al. Metformin is associated with improved survival in endometrialcancer // Gynecol Oncol. – 2014. – Vol.132. – P.438–442.
- Lee C., Jung M., Jung I. et al. Cumulative metformin use and its impact on survival in gastric cancer patients after gastrectomy // Ann Surg. – 2016. – Vol.263. – P.96–102.
- Fortune-Greeley A., Williams C., Paulus J., Kelley M. Association between metformin use and survival among non-small cell lung cancer patients // ASCO Meeting Abstr. – 2014. –Vol.32. – P.7568
- Comparison of Melatonin or Metformin and Dacarbazine Combination Versus Dacarbazine Alone in Disseminated Melanoma // ClinicalTrials.gov Identifier: NCT02190838
- Neoadjuvant FDC With Melatonin or Metformin for Locally Advanced Breast Cancer // ClinicalTrials.gov Identifier: NCT02506777
- Neoadjuvant Toremifene With Melatonin or Metformin in Locally Advanced Breast CancerClinicalTrials.gov Identifier: NCT02506790
Материал подготовил Михаил Анатольевич Осипов, лаборант-исследователь Научного отдела инновационных методов терапевтической онкологии и реабилитации.
