Основные результаты научно-исследовательской работы и перспективы химиопрофилактики рака
Достижения и перспективы химиопрофилактики рака
С середины 80-х годов 20 века в лаборатории предклинических испытаний, наряду с работами прикладного характера, определилось самостоятельное научное направление по разработке проблемы химиопрофилактики опухолей (В.Г. Беспалов, В.А. Александров), основываясь на современных принципах, которые практически не изменились до сих пор. Разработка средств для химиопрофилактики рака является сложным и длительным процессом, который должен проходить следующие этапы: доклиническое изучение антиканцерогенной активности на моделях опухолей различных органов и оценка возможных токсических свойств, предварительное клиническое изучение эффективности и безопасности у относительно небольшого числа пациентов из групп повышенного риска злокачественных опухолей, итоговое клиническое изучение на больших контингентах пациентов с оценкой онкологической заболеваемости и смертности. Перспективными для химиопрофилактики рака являются вещества, обладающие выраженным антиканцерогенным действием на широком спектре экспериментальных моделей опухолей, не имеющие токсических свойств, показавшие эффективность и безопасность в клинических исследованиях.
Цель химиопрофилактики – поиск эффективных средств (природных и синтетических), способных тормозить или препятствовать возникновению и развитию опухолей и внедрение наиболее активных препаратов в клиническую практику.
Средства для профилактики рака должны отвечать следующим основным требованиям:
- доказанная в клинических испытаниях эффективность;
- возможность применения в течение длительного времени – многолетнего или даже постоянного в течение всей жизни;
- отсутствие токсических эффектов и побочных действий или минимальная токсичность, чтобы риск возможных осложнений при использовании онкопрофилактического препарата был допустимым в сравнении со снижением риска возникновения рака;
- желательны дополнительные благоприятные свойства, достигаемые в более короткие сроки;
- лекарственные формы должны быть преимущественно для перорального применения, в некоторых случаях – местными для нанесения на кожу и слизистые оболочки.
Усилия в разработке этой проблемы были сосредоточены на поиске препаратов, способных ингибировать канцерогенез при их использовании, в основном, в период постинициации, т.е. в фазу промоции и прогрессии опухолей. Именно такой подход является наиболее перспективным для химиопрофилактики рака, поскольку показания к применению антипромоторных препаратов необычайно широки: среди популяции практически здоровых лиц, живущих в экологически неблагоприятных условиях; в группах с высоким риском развития рака; среди больных с преопухолевыми заболеваниями; у онкологических больных в период ремиссии после проведенного радикального лечения.
С первых шагов разработки проблемы химиопрофилактики рака решалась важная и трудоемкая задача по отработке моделей опухолей (как злокачественных, так и доброкачественных), вызываемых с достаточно высокой частотой в течение относительно непродолжительного времени (не более 1–1,5 лет), особенно тех локализаций, которые относятся к наиболее распространенным. В итоге в лаборатории были освоены, а также разработаны новые оригинальные экспериментальные модели всех основных опухолей, встречающихся у человека (табл. 1). Кроме того, в лаборатории была разработана модель опухолей молочной железы, эндокринной и репродуктивной систем и других органов, индуцированных гамма-облучением, у крыс; многоорганные модели канцерогенеза, вызываемого химическими канцерогенами.
Таблица 1. Экспериментальные модели предрака и рака, применяемые в лаборатории, для изучения антиканцерогенных средств
|
Локализация |
Метод индукции |
Гистологический тип |
|
Молочная железа |
МНМ интраммамарно, МНМ или ДМБА в/в у крыс |
Аденокарциномы, фиброаденомы |
|
Простата |
Инициация МНМ в/в + промоция тестостероном в/б у крыс |
Простатическая интраэпителиальная неоплазия, аденокарциномы |
|
Легкое |
МХ интратрахеально у крыс, уретан в/б у мышей |
Аденокарциномы, аденомы |
|
Толстая кишка |
АОМ п/к у крыс и мышей, МНМ интраректально у крыс |
Очаги аберрантных крипт, аденокарциномы |
|
Желудок |
МННГ п/о |
Аденокарциномы |
|
Пищевод |
МБНА или ЭЭНС п/о |
Плоскоклеточные карциномы, папилломы |
|
Печень |
ДЭНА в/б у крыс и мышей |
Пренеопластические очаги, гепатоцеллюлярные карциномы |
|
Кожа |
ДМБА + ТПА или БП накожно |
Плоскоклеточные карциномы, папилломы |
|
Шейка матки |
ДМБА внутривлагалищно |
Плоскоклеточные карциномы |
|
Нервная система |
ЭНМ трансплацентарно |
Глиомы головного и спинного мозга, невриномы периферических нервов |
|
Почка |
ЭНМ трансплацентарно |
Мезенхимальные опухоли |
АОМ – азоксиметан, БП – бензо(а)пирен, ДЭНА – N-диэтилнитрозоамин, ДМБА – 7,12-диметилбенз(а)антрацен, МБНА - N-метил-N-бензилнитрозамин, МНМ – N-метил-N-нитрозомочевина, МННГ – N-метил-N-нитро-N’-нитрозогуанидин, МХ – 3-метилхолантрен, ТПА – 12-О-тетрадеканоилфорбол 13-ацетат, ЭНМ – N-этил-N-нитрозомочевина, ЭЭНС – этиловый эфир N-нитрозосаркозина; в/б – внутрибрюшинно, в/в – внутривенно, п/к – подкожно, п/о – перорально
Основные результаты научно-исследовательской работы
Доклиническое и клиническое изучение антиканцерогенной активности синтетических и природных веществ
К настоящему времени на различных моделях опухолей изучено более 80 веществ, и из них более 50 проявило антиканцерогенную активность, основные из которых представлены в табл. 2. В результате проведенной работы впервые выявлен ряд новых антиканцерогенных веществ, у известных ингибиторов установлена способность тормозить развитие опухолей ранее неизвестных локализаций.
Таблица 2. Ингибиторы канцерогенеза, изученные в лаборатории
|
Класс соединений |
Препараты и вещества |
|
Витамины |
Ретинол, альфа-токоферол, аскорбиновая кислота, тиамин, рибофлавин, витаминно-минеральные комплексы |
|
Каротиноиды |
Бета-каротин обычный и липосомальный |
|
Ретиноиды |
13-Цис-ретиноевая кислота |
|
Минералы |
Селенит натрия, молибдат натрия, цинка сульфат |
|
Нестероидные противовоспалительные средства |
Ортофен, индометацин |
|
Ингибиторы фосфодиэстеразы |
Теофиллин, пентоксифиилин |
|
Нейрофармакологические препараты |
Диазепам, дифенин, карбонат лития |
|
Пептидные биорегуляторы |
Тималин, тимоген, эпиталамин, кортексин |
|
Антидиабетические препараты |
Фенформин |
|
Ингибиторы орнитиндекарбоксилазы |
альфа-Дифторметилорнитин |
|
Ингибиторы протеаз |
Аминокапроновая кислота |
|
Фенолы |
Фенозан |
|
Органические кислоты и их соли |
Фумаровая кислота, глюкарат кальция, глюкуронат калия |
|
Биотехнологические растительные препараты |
Биоженьшень, панаксел |
|
Экстракты лекарственных растений |
Betula pendula, Eleutherococcus senticosus, Filipendula ulmaria, Glycyrrhiza glabra, Plantago major, Rhaponticum cartamoides, Urtica dioica |
|
Пищевые вещества и природные комплексы |
Концентрат ламинарии, масло зародышей пшеницы, пренолы из хвои, провитаминный концентрат из хвои, оксигумат торфяной, отруби пшеницы, рыбий жир, хвойный комплекс, экстракт фукусный |
На основании полученных результатов по всем испытанным веществам на разных моделях были сделаны важные общие выводы:
- Длительное применение онкопрофилактических средств в постиниционный период не позволяет добиться полного 100%-ного торможения канцерогенеза, хотя снижение частоты и/или множественности может достигать 60%, но чаще около 30% (при статистической достоверности).
- Способность к ингибированию канцерогенеза даже известных онкопрофилактических средств (ретинол, ?-токоферол, 13-цис-ретиноевая кислота, ?-дифторметилорнитин и др.) не всегда подтверждалась, поэтому для гарантированного выявления активности у новых веществ необходимо проводить тестирование на нескольких моделях (не менее трех).
- Проявление онкопрофилактических свойств не является уникальным для какой-то определенной группы препаратов; отчетливая активность может быть выявлена у довольно широкого ряда синтетических и природных веществ с различным механизмом действия.
- В целом, комплексные природные вещества не уступают синтетическим соединениям по антиканцерогенной эффективности. В то же время, преимуществом природных веществ является их потенциально более низкая токсичность.
- У ряда веществ антиканцерогенная активность сочетается с другими позитивными фармакологическими эффектами: антиатеросклеротическим, адаптогенным, иммуномодулирующим, противовоспалительным, антиоксидантным и др.
- У комбинаций антиканцерогенных агентов выраженность и спектр антиканцерогенного действия может быть выше, а токсические эффекты менее выражены по сравнению с отдельными компонентами.
В результате экспериментов были отобраны и предложены для дальнейшего клинического изучения наиболее эффективные и безопасные антиканцерогенные вещества. Разработан алгоритм клинических исследований химиопрофилактических препаратов у пациентов из групп повышенного риска рака молочной железы, желудка, легких, толстой кишки с использованием клинических, эндоскопических, гормональных, биохимических, иммунологических, эхографических, рентгенологических, гистологических, цитологических, цитоморфометрических исследований и оценкой влияния на промежуточные биомаркеры повышенного онкологического риска. В проведенных клинических испытаниях выявлены химиопрофилактические средства, оказывающие выраженное лечебное действие на патологические сдвиги у пациентов из групп повышенного онкологического риска. Кламин (БАД на основе концентрата ламинарии) ослаблял симптомы диспепсии и эндоскопические признаки гастрита, увеличивал уровень пепсиногена-пепсина в желудочном соке, вызывал регрессию кишечной метаплазии и дисплазии у больных атрофическим гастритом; улучшал клинико-рентгенологическую картину, вызывал регрессию дисплазии и метаплазии эпителия бронхов у больных хроническим бронхитом курильщика; вызывал регрессию предраковых очагов у больных красным плоским лишаем ротовой полости; нормализовал стул, подавлял повышенную пролиферацию эпителия слизистой оболочки и вызывал частичную регрессия полипов у пациентов с аденоматозными полипами толстой кишки. Лесмин (БАД на основе хвойного комплекса) ослаблял симптомы диспепсии и эндоскопические признаки гастрита, подавлял инфекцию Helicobacter pylori, увеличивал уровень пепсиногена-пепсина в желудочном соке, вызывал регрессию лимфоплазмоцитарной инфильтрации и кишечной метаплазии слизистой оболочки желудка у больных атрофическим гастритом. Результаты доклинического и клинического изучения пищевых веществ и разработанных в лаборатории на их основе БАД опубликованы в нескольких монографиях (в частности: Беспалов В.Г. Питание и профилактика онкологических заболеваний. – Великий Новгород, Полиграфическая компания "Позитив", 2015. – 242 с.).
На основе концентрата ламинарии в качестве фармацевтической субстанции был создан и внедрен в клиническую практику лекарственный препарат мамоклам, который применяется для лечения фиброзно-кистозной болезни молочных желез. В проведенных клинических испытаниях установлено, что мамоклам значительно уменьшает проявления масталгии, предменструального напряжения молочных желез и альгоменореи, ослабляет пальпаторные признаки фиброзно-кистозной болезни, нормализует менструальный цикл, баланс тиреоидных и половых гормонов; по данным маммографии и эхографии вызывает регрессию фиброаденоматозных уплотнений и кист в ткани молочных желез, приводит к уменьшению диаметра расширенных млечных протоков, снижает маммографическую плотность. Результаты клинического изучения мамоклама обобщены в монографии: Беспалов В.Г. Мастопатия и лекарственный препарат мамоклам. Методическое пособие для врачей. – СПб.: Издательство "Игра света", 2008. – 68 с.
Доклиническое и клиническое изучение противоопухолевой активности фармакологических веществ и препаратов
В последние годы нами были пересмотрены результаты изучения ранее синтезированных противоопухолевых препаратов, чтобы выявить наиболее перспективные для внедрения в клиническую практику после более углубленного и широкого экспериментального исследования. Наибольший интерес привлекли два препарата: диоксадэт и хлонизол.
Диоксадэт относится к группе алкилирующих соединений – этилениминов. В лаборатории были разработаны новая схема синтеза фармацевтической субстанции и новая лекарственная лиофилизированная форма препарата, которые обеспечивают большую безопасность в производстве; разработан новый проект ФСП на лекарственную форму; проведены доклинические исследования по оценке противоопухолевой активности диоксадэта на стандартных моделях трансплантированных опухолей в сравнении с цитостатиками, применяемыми в клинической практике.
В доклинических исследованиях была установлена выраженная противоопухолевая активность диоксадэта на широком спектре перевиваемых опухолей у лабораторных животных. Данные сравнительного изучения диоксадэта свидетельствуют о его более высокой противоопухолевой активности, чем у наиболее близкого к нему по структуре тиофосфамида. В эксперименте на крысах с перевиваемой асцитной опухолью яичника противоопухолевое действие диоксадэта при внутрибрюшинном введении сравнимо с действием цисплатина, являющегося стандартом в клинической интраперитонеальной химиотерапии рака яичника. С учетом того, что диоксадэт, в отличие от препаратов платины, обладает значительно более низкой токсичностью, не вызывает осложнений в виде спаечного процесса, перспективным является применение диоксадэта для интраперитонеальной химиотерапии рака яичника. В экспериментах с асцитной опухолью Эрлиха у мышей выявлен выраженный синергизм противоопухолевого действия диоксадэта в комбинации с гемцитабином при отсутствии повышения токсичности.
Клинические испытания диоксадэта по II фазе были проведены в 15 онкологических учреждениях у 229 больных распространенными формами злокачественных новообразований различных локализаций. Несмотря на то, что все больные были с далеко зашедшими формами злокачественных новообразований, практически при всех локализациях был доказан объективный противоопухолевый эффект диоксадэта. Особенно сильным противоопухолевый эффект диоксадэта оказался в лечении распространенных форм рака яичников и молочной железы, в том числе у больных с асцитом и ранее леченных другими алкилирующими агентами. Были проведены клинические испытания диоксадэта в качестве противоопухолевого средства для химиоэмболизации при операбельных и распространенных формах рака почки. Химиоэмболизация с диоксадэтом повышала 2- и 3-летнюю выживаемость больных неоперабельным раком почки. Были проведены клинические испытания диоксадэта в качестве противоопухолевого средства для химиоэмболизации печеночной артерии у больных с первичным раком печени и метастазами в печень колоректального рака. Была доказана эффективность химиоэмболизации с диоксадэтом в виде получения объективного противоопухолевого ответа и увеличения выживаемости больных.
Диосадэт обладает выраженным так называемым контактным противопухолевым действием. В настоящее время в лаборатории развивается направление использования диоксадэта в различных режимах интраперитонеальной химиотерапии канцероматоза брюшной полости. Доклинические исследования показали, что диоксадэт при интраперитонеальной химиотерапии превосходит по эффективности и безопасности другие применяемые с этой целью цитостатики: циспалатин, паклитаксел, митомицин С, мелфалан.
Создана экспериментальная установка для химиоперфузионного лечения канцероматоза брюшной полости на моделях у крупных и мелких лабораторных животных.
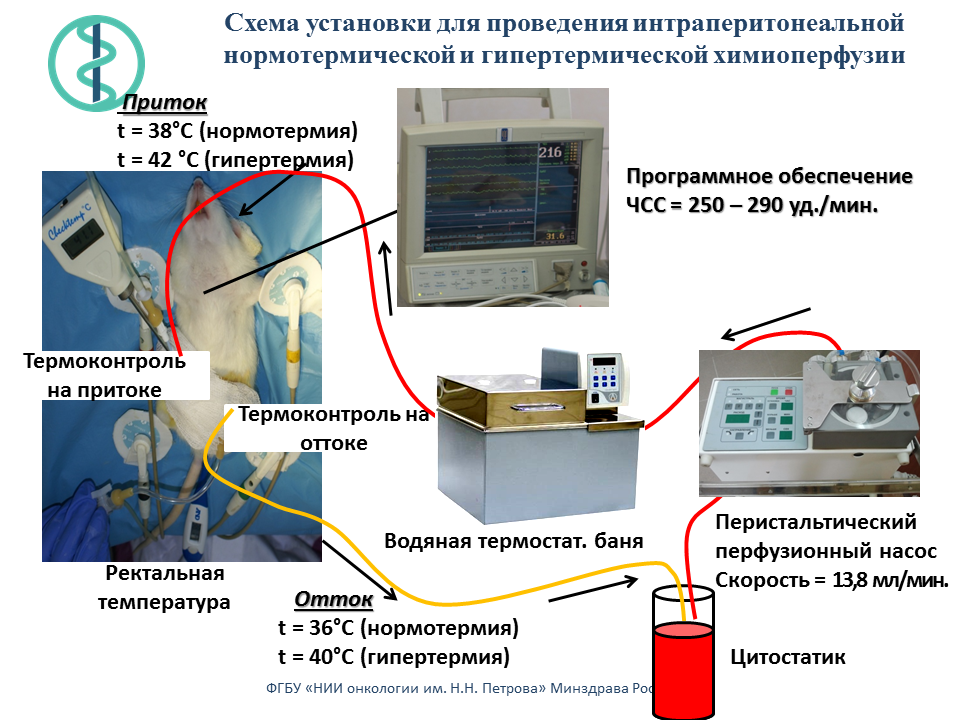
Результаты доклинического и клинического изучения химиоперфузионного лечения злокачественных опухолей обобщены в монографии: Беляева О. А., Беспалов В. Г., Сенчик К. Ю., Киреева Г. С., СтуковА. Н., Гафтон Г. И., Карачун А. М., Гусейнов К. Д. Беляев А. М. Химиоперфузионное лечение канцероматоза брюшной полости. – СПб., 2016. – 146 с.
Проведено сравнительное статистическое исследование результатов восьми независимых экспериментов по изучению эффективности интраперитонеальной химиотерапии. Изучены режимы инъекционной внутрибрюшинной (в/б) химиотерапии (ИВХ), нормо– и гипертермической химиоперфузии (НИПХ и ГИПХ) препаратом диоксадэт на модели перевиваемого асцитного рака яичника (РЯ) у 288 крыс самок Вистар. Перевивка РЯ осуществляли в/б в количестве 1?107 опухолевых клеток, интраперитонеальную химиотерапию проводили однократно через 48 часов после трансплантации опухоли. Диоксадэт вводили в максимально переносимых дозах в/б: при ИВХ с помощью шприца в дозе 1,5 мг/кг массы тела; при НИПХ и ГИПХ раствор с цитостатиком прокачивали через брюшную полость специальным насосом соответственно в дозе 30 мг/кг при температуре 36,5–37,5°С и 15 мг/кг при температуре 40,5–41,5°С. В контрольных группах крысам в/б аналогичными путями вводили физиологический раствор. Противоопухолевые эффекты лечения оценивали по увеличению средней продолжительности жизни крыс. Для статистического анализа использован принцип гармонизации статистических доказательств и предсказаний. В контрольной группе с инъекционным в/б введением физиологического раствора средняя продолжительность жизни составила 15 дней, 95% доверительный интервал (ДИ) от 12 до 19. По сравнению с данным контролем воздействие ИВХ, НИПХ и ГИПХ увеличивало среднюю продолжительность жизни соответственно на 85, 97 и 202% (p<0.001 для всех трех случаев). Наиболее эффективным режимом интраперитонеальной химиотерапии является ГИПХ с диоксадэтом, а наиболее безопасным – ИВХ с диоксадэтом.
Полученные нами данные и анализ литературы позволяют предположить, что результаты лечения канцероматоза брюшной полости у больных при раке яичника и других локализаций можно значительно улучшить путем использования интраперитонеальной химиотерапии. На наш взгляд, наиболее оптимальным будет комплексный подход к лечению таких пациенток. Этап циторедуктивного оперативного вмешательства целесообразно дополнить ГИПХ, а затем вместо адъювантной системной химиотерапии проводить курсы адъювантной интраперитонеальной химиотерапии. Препарат диоксадэт по своей эффективности и безопасности при различных режимах интраперитонеальной химиотерапии имеет преимущества по сравнению с наиболее часто используемым сегодня для этой цели цисплатином, что говорит о перспективности внедрения диоксадэта в клиническую практику в качестве основного препарата для ГИПХ и интраперитонеальной химиотерапии через катетер у больных диссеминированным раком яичника.
Хлонизол относится к классу нитрозоалкилмочевин. В экспериментах на животных с перевиваемыми опухолями было установлено, что хлонизол обладает высокой противоопухолевой активностью, значительно превосходя как по спектру, так и по выраженности противопухолевого действия свой ближайший структурный аналог ССNU (ломустин, белустин), а также другие широко применяемые в клинической практике препараты (аранозу, доксорубицин, циклофосфан). Противоопухолевый эффект хлонизола показан на 12 перевиваемых опухолях. Отличительным свойством хлонизола является хорошая проницаемость через гематоэнцефалический барьер и выраженный эффект при лечении экспериментальных опухолей головного мозга. Поэтому дальнейшее его изучение должно быть направлено на применение у больных с опухолями головного мозга и метастазами в головной мозг. Хлонизол также перспективен для лечения злокачественных лимфом, диссеминированной меланомы, мелкоклеточного рака легкого.
